Implémentation rapide de conceptions de cytomètres en flux à l'aide de modules d'acquisition de données haute précision
Avec la contribution de Rédacteurs nord-américains de DigiKey
2022-04-21
La cytométrie en flux est largement utilisée par les cliniciens et les diagnosticiens pour analyser les caractéristiques des cellules. Cellule par cellule, ils évaluent optiquement les niveaux de protéines, la santé du sang, la granularité et la taille des cellules, entre autres attributs. Bien qu'il s'agisse de systèmes très sensibles, les concepteurs de cytomètres sont soumis à une pression constante pour accélérer le temps d'analyse, ce qui nécessite de nouvelles approches tant pour la cytométrie en flux que pour l'électronique associée.
Les cytomètres soumettent les cellules individuelles à la lumière laser pour créer des signaux diffus et fluorescents. Pour capturer rapidement et précisément la lumière résultante et la convertir en signaux numériques, une photodiode à avalanche (APD) et une électronique complexe sont requises. La conception et la mise en œuvre des circuits nécessaires à ce processus peuvent prendre beaucoup de temps, d'autant plus que les systèmes d'acquisition de données de cytométrie en flux nécessitent des dispositifs à haute vitesse et faible bruit pour garantir la précision du système.
Pour prendre en charge de manière rentable des analyses de cytométrie en flux plus rapides, les concepteurs peuvent résoudre les problèmes de vitesse et de précision avec une solution d'acquisition de données comprenant des circuits d'attaque d'amplificateurs internes et un convertisseur analogique-numérique (CAN).
Cet article décrit brièvement le fonctionnement des systèmes de cytométrie en flux. Il présente ensuite l'ADAQ23878 d'Analog Devices, un module CAN 18 bits, et montre comment l'utiliser pour concevoir un étage de détection et de conversion de cytomètre en flux. Un kit d'évaluation associé est également présenté.
Principes de la cytométrie en flux moderne
La cytométrie en flux moderne est un processus automatisé qui analyse et caractérise les molécules cellulaires et de surface, et définit différents types de cellules dans une population cellulaire hétérogène. Sans compter le temps de préparation, qui peut être supérieur à une heure, l'instrument effectue une évaluation de trois à six caractéristiques de 10 000 cellules uniques en moins d'une minute.
Pour ce faire, l'étape de préparation des cellules uniques de cytométrie en flux est essentielle. L'organisation des échantillons se fait de manière hydrodynamique dans un liquide de gaine pour concentrer les cellules ou les particules dans un flux d'échantillons étroit à lignée unicellulaire pour l'analyse. Avec cette transformation, les cellules uniques doivent conserver leurs caractéristiques biologiques et leurs composants biochimiques naturels.
La Figure 1 montre le schéma d'un cytomètre en flux qui commence en haut avec l'échantillon de cellules multiples.
 Figure 1 : Schéma d'un cytomètre en flux, de la focalisation de gaine à l'acquisition de données. (Source de l'image : Wikipédia, modifiée par Bonnie Baker)
Figure 1 : Schéma d'un cytomètre en flux, de la focalisation de gaine à l'acquisition de données. (Source de l'image : Wikipédia, modifiée par Bonnie Baker)
Les six principaux composants du cytomètre en flux sont une cellule de flux, un laser, une photodiode à avalanche (APD), un amplificateur d'adaptation d'impédance (TIA), un CAN et un ordinateur pour la collecte et l'analyse des données.
Le cytomètre en flux est doté d'un flux liquidien ou liquide de gaine, qui se rétrécit pour transporter et aligner les cellules en une seule file dans le faisceau lumineux. La lumière laser capture une cellule à la fois, créant un signal de lumière à diffusion frontale (FSC) et un signal de lumière à diffusion latérale (SSC). La lumière fluorescente est triée à l'aide de miroirs et de filtres, puis amplifiée par une photodiode à avalanche.
L'étape suivante consiste à détecter, numériser et analyser la sortie lumineuse résultante une fois qu'elle a atteint la photodiode à avalanche. Pour la détection, l'amplificateur opérationnel à entrée FET, à faible tension de bruit et courant de polarisation ultrafaible, 500 mégahertz (MHz) LTC6268 d'Analog Devices est idéal pour le TIA haute vitesse nécessaire à la détection.
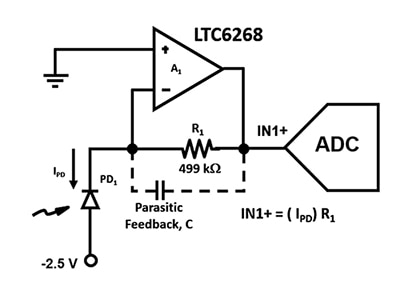 Figure 2 : Le circuit TIA utilise une photodiode à avalanche (PD1) et un amplificateur opérationnel FET à faible courant d'entrée pour convertir les courants de photodiode ultrafaibles en une tension de sortie à IN1+. (Source de l'image : Bonnie Baker)
Figure 2 : Le circuit TIA utilise une photodiode à avalanche (PD1) et un amplificateur opérationnel FET à faible courant d'entrée pour convertir les courants de photodiode ultrafaibles en une tension de sortie à IN1+. (Source de l'image : Bonnie Baker)
Comme il est essentiel de concevoir ce circuit d'amplificateur avec la bande passante la plus large possible, les capacités parasites doivent donc être minimisées. Par exemple, la capacité de réaction parasite, C, influence la stabilité du circuit et la bande passante de la Figure 2. Quel que soit le choix de boîtier pour les résistances, il y aura toujours une capacité parasite dans le chemin de réaction de l'amplificateur. Cependant, pour les applications haute vitesse, il est préférable d'utiliser un boîtier 0805, qui présente la plus faible capacité parasite et un espacement plus grand entre les extrémités.
Augmenter la distance entre les extrémités de R1 n'est pas le seul moyen de diminuer la capacité. Une autre façon de réduire la capacité plaque à plaque est de blinder les chemins de champ E à l'origine de la capacité parasite en plaçant une piste de terre supplémentaire sous la résistance, R1 (Figure 3).
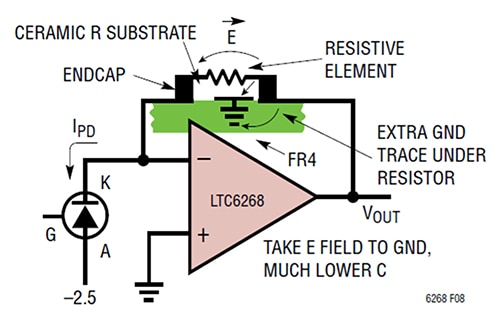 Figure 3 : L'ajout d'une piste de terre sous la résistance de contre-réaction dévie le champ E du côté de la contre-réaction et le décharge à la terre. (Source de l'image : Analog Devices)
Figure 3 : L'ajout d'une piste de terre sous la résistance de contre-réaction dévie le champ E du côté de la contre-réaction et le décharge à la terre. (Source de l'image : Analog Devices)
Dans ce cas, la méthode consiste spécifiquement à placer une courte piste de terre sous et entre les plots de résistance près de l'extrémité de sortie du TIA. Cette technique donne une valeur de capacité parasite de 0,028 picofarad (pF) avec une largeur de bande TIA de 1/(2π*RF*CPARASITIC), correspondant à 11,4 MHz.
Les signaux lumineux optiques pointent vers plusieurs diodes à avalanche avec des filtres optiques appropriés. Les systèmes APD, TIA et CAN convertissent ces signaux en leur représentation numérique et envoient les données au microprocesseur pour une analyse plus approfondie.
Les instruments modernes sont généralement dotés de plusieurs lasers et APD. Les dispositifs commerciaux actuels comptent dix lasers et trente photodiodes à avalanche. L'augmentation du nombre de détecteurs photomultiplicateurs et lasers permet un marquage multiple d'anticorps pour identifier précisément les populations cibles par marqueurs phénotypiques.
Cependant, la rapidité de l'analyse dépend d'un équilibre délicat :
- Vitesse de la gaine de liquide
- Capacité du processus de focalisation hydrodynamique à former des lignées unicellulaires
- Diamètre du tunnel
- Capacité à préserver l'intégrité d'une cellule
- Électronique
Focalisation acoustique de cytométrie en flux
Si l'ajout de plusieurs lasers et APD accélère l'analyse et l'identification, au mieux, les dernières méthodes modernes de cytométrie en flux unicellulaire peuvent collecter des données sur un million de cellules individuelles par minute. Dans de nombreuses applications, comme la détection de cellules tumorales circulantes présentes dans le sang à des niveaux de seulement 100 cellules par millilitre, cela est inadéquat. Dans les applications cliniques de cellules rares, les tests nécessitent régulièrement l'analyse fastidieuse de milliards de cellules.
L'alternative au processus de préparation des cellules par focalisation hydrodynamique est un processus de focalisation acoustique. Ici, un matériau piézoélectrique, tel que le titano-zirconate de plomb (PZT), est fixé à un capillaire en verre pour convertir les impulsions électriques en vibrations mécaniques (Figure 4a). En utilisant le PZT pour faire vibrer les parois latérales d'un capillaire en verre à la fréquence de résonance de la cellule de flux rectangulaire, le système génère une variété d'ondes stationnaires acoustiques avec un nombre variable de nœuds de pression.
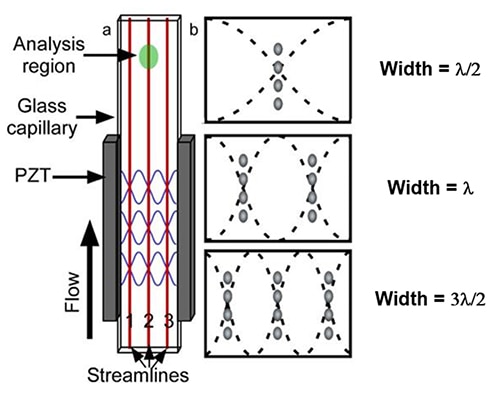 Figure 4 : Illustration d'une cellule de flux acoustique avec un capillaire en verre rectangulaire (a). Emplacement des trois premiers nœuds de pression pour un capillaire de largeur fixe (b). (Source de l'image : National Center for Biotechnology Information)
Figure 4 : Illustration d'une cellule de flux acoustique avec un capillaire en verre rectangulaire (a). Emplacement des trois premiers nœuds de pression pour un capillaire de largeur fixe (b). (Source de l'image : National Center for Biotechnology Information)
Ces nœuds de fréquence PZT alignent les particules qui circulent en plusieurs lignes de courant discrètes (Figure 4b). La cellule de flux acoustique utilise une onde acoustique stationnaire linéaire pour s'ajuster à différentes longueurs d'ondes en générant une ou plusieurs harmoniques. Comme le prédit le modèle d'onde stationnaire linéaire simple, les cellules de l'échantillon produisent une ou plusieurs lignées unicellulaires dans la chambre de flux.
Grâce à cette organisation précise des cellules, la largeur du tunnel de la gaine de flux peut augmenter pour permettre des débits plus rapides devant le faisceau laser (Figure 5).
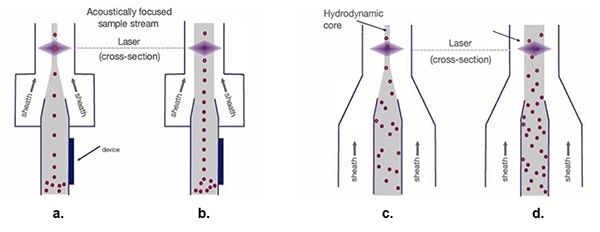 Figure 5 : Avec les flux d'échantillons hydrodynamiques (c. et d.), lorsque la largeur de la gaine augmente, les échantillons de cellules se dispersent, ce qui rend le processus de mesure optique difficile. Les flux d'échantillons à focalisation acoustique (a. et b.) maintiennent les cellules dans une seule file quelle que soit la largeur de la gaine. (Source de l'image : Thermo Fischer Scientific)
Figure 5 : Avec les flux d'échantillons hydrodynamiques (c. et d.), lorsque la largeur de la gaine augmente, les échantillons de cellules se dispersent, ce qui rend le processus de mesure optique difficile. Les flux d'échantillons à focalisation acoustique (a. et b.) maintiennent les cellules dans une seule file quelle que soit la largeur de la gaine. (Source de l'image : Thermo Fischer Scientific)
La focalisation hydrodynamique traditionnelle (Figure 5c.) permet d'organiser les lignées unicellulaires en vue du balayage laser. Un tunnel plus large pour le cœur du flux d'échantillons permet certes d'augmenter la vitesse du matériau de la gaine (Figure 5d.), mais il entraîne également la dispersion de l'organisation unicellulaire, produisant une variation des signaux et compromettant la qualité des données.
La focalisation acoustique (Figure 5a.) permet de positionner les cellules biologiques et autres particules en un alignement étroit, même avec un tunnel plus large. Cet alignement précis des cellules permet des taux d'échantillonnage plus élevés tout en maintenant la qualité des données (Figure 5b.).
En pratique, la focalisation acoustique dans la cytométrie en flux multiplie la fréquence d'échantillonnage des cellules par ~20 (Figure 6).
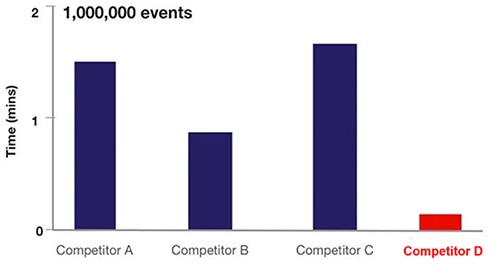 Figure 6 : Comparaison du temps d'échantillonnage pour divers équipements de cytométrie en flux basés sur la cytométrie en flux liquide (A, B, C) par rapport à la cytométrie à focalisation acoustique (D). (Source de l'image : Thermo Fischer Scientific)
Figure 6 : Comparaison du temps d'échantillonnage pour divers équipements de cytométrie en flux basés sur la cytométrie en flux liquide (A, B, C) par rapport à la cytométrie à focalisation acoustique (D). (Source de l'image : Thermo Fischer Scientific)
Dans la Figure 6, les équipements de A, B et C utilisent la technologie hydrodynamique, tandis que D utilise l'approche de flux de cytométrie à focalisation acoustique.
Acquisition de données de cytométrie en flux à focalisation acoustique
La conception de l'électronique pour l'équipement de cytométrie en flux à focalisation acoustique requiert une électronique de photodétection haute vitesse pour s'adapter à la vitesse des cellules sanguines et du liquide de gaine à travers la buse de plus grand diamètre. Le LTC6268 600 MHz haute vitesse mentionné précédemment, associé à une disposition de boîtier de résistance 0805 spécialisée, porte la fréquence de détection optique à 11,4 MHz (Figure 7, gauche). La sortie du LTC6268 est envoyée à un CAN ADAQ23878 d'Analog Devices pour être numérisée.
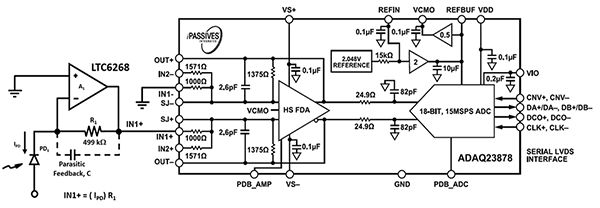 Figure 7 : Le CAN ADAQ23878 numérise le signal optique de la photodiode (PD1) et du circuit TIA (à gauche). (Source de l'image : Bonnie Baker)
Figure 7 : Le CAN ADAQ23878 numérise le signal optique de la photodiode (PD1) et du circuit TIA (à gauche). (Source de l'image : Bonnie Baker)
L'ADAQ23878 est une solution d'acquisition de données de précision et haute vitesse de 18 bits, 15 méga-échantillons par seconde (Méch./s), de type système en boîtier (SIP). Il réduit considérablement le cycle de développement des systèmes de mesure de précision en transférant la charge de sélection, d'optimisation et de configuration des composants du circuit d'attaque d'entrée du concepteur au dispositif.
L'approche modulaire du SIP réduit le nombre de composants du système terminal en combinant plusieurs blocs communs de traitement et de mise en forme des signaux dans un seul dispositif, ainsi que le CAN à registre d'approximations successives (SAR) 18 bits, 15 Méch./s haute vitesse. Ces blocs incluent un amplificateur de circuit d'attaque CAN à faible bruit, entièrement différentiel, et un tampon de référence stable.
L'ADAQ23878 intègre également des composants passifs critiques qui utilisent la technologie iPassive d'Analog Devices pour minimiser les sources d'erreurs liées à la température et optimiser les performances. L'étage de circuit d'attaque à stabilisation rapide du CAN contribue à garantir une acquisition rapide des données.
Évaluation du µModule ADAQ23878
Pour évaluer l'ADAQ23878, Analog Devices fournit la carte d'évaluation EVAL-ADAQ23878FMCZ (Figure 8). La carte démontre les performances du μModule ADAQ23878 et constitue un outil polyvalent pour évaluer une conception de circuit d'entrée de cytométrie en flux, ainsi qu'une variété d'autres applications.
 Figure 8 : La carte d'évaluation EVAL-ADAQ23878FMCZ pour l'ADAQ23878 est équipée de circuits d'alimentation embarqués, elle est fournie avec un logiciel associé pour le contrôle et l'analyse des données, et elle est compatible SDP-H1. (Source de l'image : Analog Devices)
Figure 8 : La carte d'évaluation EVAL-ADAQ23878FMCZ pour l'ADAQ23878 est équipée de circuits d'alimentation embarqués, elle est fournie avec un logiciel associé pour le contrôle et l'analyse des données, et elle est compatible SDP-H1. (Source de l'image : Analog Devices)
La carte d'évaluation EVAL-ADAQ23878FMCZ requiert un ordinateur fonctionnant sous Windows 10 ou version ultérieure, une source de signaux de précision à faible bruit et un filtre passe-bande adapté aux tests 18 bits. La carte d'évaluation nécessite le plugin ADAQ23878 ACE et le pilote SDP-H1.
Conclusion
L'examen d'une seule cellule biologique à la fois à l'aide des techniques de cytométrie en flux à focalisation hydrodynamique standard a fait ses preuves, mais avec le besoin d'analyses plus rapides, des techniques basées sur des méthodes de flux à focalisation acoustique ont fait leur apparition. Cependant, l'électronique prenant en charge la cytométrie en flux plus avancée doit également s'améliorer, tout en minimisant l'espace, le coût et le temps de développement.
Comme illustré, l'amplificateur opérationnel haute vitesse LTC6268 et la solution d'acquisition de données μModule haute vitesse de précision ADAQ23878 peuvent être combinés pour créer un système d'acquisition de données complet pour les équipements de cytométrie en flux avancés.

Avertissement : les opinions, convictions et points de vue exprimés par les divers auteurs et/ou participants au forum sur ce site Web ne reflètent pas nécessairement ceux de DigiKey ni les politiques officielles de la société.







